Алканы вещества. Полезное видео: алканы — строение молекул, физические свойства
В таблице представлены некоторые представители ряда алканов и их радикалы.
|
Формула |
Название |
Название радикала |
|||||||||||
|
CH3 метил |
|||||||||||||
|
C3H7 пропил |
|||||||||||||
|
C4H9 бутил |
|||||||||||||
|
изобутан |
изобутил |
||||||||||||
|
изопентан |
изопентил |
||||||||||||
|
неопентан |
неопентил |
||||||||||||
|
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп - СН2 -.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами. Гомологи - вещества сходные по строению и свойствам, но отличающиеся по составу на одну или несколько гомологических разностей (- СН2 -)
Углеродная цепь - зигзаг (если n ≥ 3) σ - связи (свободное вращение вокруг связей) длина (-С-С-) 0,154 нм энергия связи (-С-С-) 348 кДж/моль Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации
угол между связями С-C составляет 109°28", поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг). Длина связи С-С в предельных углеводородах равна 0,154 нм (1нм=1*10-9м). а) электронная и структурная формулы; б) пространственное строение
4. Изомерия - характерна СТРУКТУРНАЯ изомерия цепи с С4 Один из этих изомеров (н -бутан) содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную (изостроение). Атомы углерода в разветвленной цепи различаются типом соединения с другими углеродными атомами. Так, атом углерода, связанный только с одном другим углеродным атомом, называется первичным , с двумя другими атомами углерода - вторичным , с тремя - третичным , с четырьмя - четвертичным . С увеличением числа атомов углерода в составе молекул увеличиваются возможности для разветвления цепи, т.е. количество изомеров растет с ростом числа углеродных атомов. Сравнительная характеристика гомологов и изомеров
1. Свою номенклатуру имеют радикалы (углеводородные радикалы)
| |||||||||||||
Алканами называют насыщенные углеводороды. В их молекулах атомы имеют одинарные связи. Структура определяется формулой CnH2n+2. Рассмотрим алканы: химические свойства, виды, применение.
В структуре углерода есть четыре орбиты, по которым вращаются атомы. Орбитали обладают одинаковой формой, энергией.
Обратите внимание! Углы между ними составляют 109 градусов и 28 минут, они направлены на вершины тетраэдра.
Простая углеродная связь позволяет алкановым молекулам свободно вращаться, в результате чего структуры приобретают различные формы, образуя вершины при атомах углерода.
Все алкановые соединения разделяются на две основные группы:
- Углеводороды алифатического соединения. Такие структуры обладают линейным соединением. Общая формула выглядит таким образом: CnH2n+2. Значение n равно или больше единицы, означает количество углеродных атомов.
- Циклоалканы циклической структуры. Химические свойства циклических алканов значительно отличаются от свойств линейных соединений. Формула циклоалканов в некоторой степени делает их схожими с углеводородами, обладающими тройной атомной связью, то есть с алкинами.
Виды алканов
Существует несколько видов алкановых соединений, каждой из которых имеет свою формулу, строение, химические свойства и алкильный заместитель. Таблица содержит гомологический ряд

Название алканов
Общая формула насыщенных углеводородов — CnH2n+2. Изменяя значение n, получают соединение с простой межатомной связью.
Полезное видео: алканы — строение молекул, физические свойства
Разновидности алканов, варианты реакций
В естественных условиях алканы являются химически инертными соединения. Углеводороды не реагируют на контактирование с концентратом азотной и серной кислоты, щелочью и перманганатом калия.
Одинарные молекулярные связи определяют реакции, характерные для алканов. Алкановые цепочки отличаются неполярной и слабо поляризуемой связью. Она несколько длиннее, нежели С-Н.

Общая формула алканов
Реакция замещения
Парафиновые вещества отличаются незначительной химической активностью. Объясняется это повышенной прочностью цепной связи, которую непросто разорвать. Для разрушения используют гомологический механизм, в котором принимают участие свободные радикалы.
Для алканов более естественны реакции замещения. Они не реагируют на молекулы воды и заряженные ионы. При замещении происходит замена водородных частиц галогеновыми и прочими активными элементами. Среди подобных процессов выделяют галогенирование, нитрирование и сульфохлорирование. Такие реакции используют для образования алкановых производных.
Свободнорадикальное замещение происходит в три основных этапа:
- Появление цепочки, на основе которой создаются свободные радикалы. В качестве катализаторов используют нагревание и ультрафиолетовый свет.
- Развитие цепочки, в структуре которой происходят взаимодействия активных и неактивных частиц. Так формируются молекулы и радикальные частицы.
- В завершение цепочка обрывается. Активные элементы создают новые комбинации или вовсе исчезают. Цепная реакция завершается.
Галогенирование
Процесс осуществляется по радикальному типу. Галогенирование происходит под воздействием ультрафиолета и температурного нагрева углеводородной и галогеновой смеси.
Весь процесс происходит по правилу Марковникова. Суть его заключается в том, что первым галогенированию подвергается атом водорода, принадлежащий гидрированному углероду. Процесс начинается с третичного атома и заканчивается первичным углеродом.
Сульфохлорирование
Другое название – реакция Рида. Осуществляется она методом свободнорадикального замещения. Таким образом, алканы реагируют на действие комбинации серного диоксида и хлора под воздействием ультрафиолетового излучения.
Реакция начинается с активизации цепного механизма. В это время из хлора выделяются два радикала. Действие одного направлено на алкан, в результате формируется молекула хлорводорода и алкильный элемент. Другой радикал соединяется с диоксидом серы, создавая сложную комбинацию. Для равновесия из другой молекулы отбирают один атом хлора. В итоге получают сульфонилхлорид алкана. Это вещество используют для выработки поверхностно-активных компонентов.

Сульфохлорирование
Нитрование
Процесс нитрования подразумевает соединение насыщенных углеродов с газообразным оксидом четырехвалентного азота и азотной кислотой, доведенной до 10% раствора. Для протекания реакции потребуется низкий уровень давления и высокая температура, приблизительно 104 градуса. В результате нитрования получают нитроалканы.
Отщепление
Посредством отделения атомов проводят реакции дегидрирования. Молекулярная частица метана полностью разлагается под влиянием температуры.
Дегидрирование
Если от углеродной решетки парафина (кроме метана) отделить атом водорода, образуются непредельные соединения. Эти реакции осуществляются в условиях значительных температурных режимов (400-600 градусов). Также используются различные металлические катализаторы.
Получение алканов происходит путем проведения гидрирования непредельных углеводородов.
Процесс разложения
При влиянии температур во время алкановых реакций могут происходить разрывы молекулярных связей, выделение активных радикалов. Эти процессы известны под названием пиролиз и крекинг.
При нагревании реакционного компонента до 500 градусов, молекулы начинают разлагаться, а на их месте формируются сложные радикальные алкильные смеси. Таким способом получают алканы и алкены в промышленности.
Окисление
Это химические реакции, основанные на отдаче электронов. Для парафинов характерно автоокисление. В процессе используется окисление насыщенных углеводородов свободными радикалами. Алкановые соединения в жидком состоянии преобразуются в гидроперекись. Сначала парафин вступает в реакцию с кислородом. Образуются активные радикалы. Затем происходит реакция алкильной частицы со второй молекулой кислорода. Формируется перекисный радикал, который в последствие взаимодействует с алкановой молекулой. В результате процесса выделяется гидроперекись.

Реакция окисления алканов
Применение алканов
Углеродные соединения имеют широкое применение практически во всех основных сферах человеческой жизни. Некоторые из видов соединений являются незаменимыми для определенных отраслей производства и комфортного существования современного человека.
Газообразные алканы – основа ценного топлива. Главным компонентом большинства газов является метан.
Метан обладает способностью создавать и выделять большое количество тепла. Поэтому его в значительных объемах применяют в промышленности, для потребления в бытовых условиях. При смешивании бутана и пропана получают хорошее бытовое топливо.
Метан используют при производстве таких продуктов:
- метанол;
- растворители;
- фреон;
- типографская краска;
- топливо;
- синтез-газ;
- ацетилен;
- формальдегид;
- муравьиная кислота;
- пластмасса.

Применение метана
Жидкие углеводороды предназначены для создания топлива для двигателей и ракет, растворителей.
Высшие углеводороды, где количество атомов углерода превышает 20, участвуют в производстве смазочных веществ, лакокрасочной продукции, мыла и моющих средств.
Комбинация жирных углеводородов, в которых менее 15 атомов Н, являет собой вазелиновое масло. Эта безвкусная прозрачная жидкость применяется в косметике, в создании парфюмов, в медицинских целях.
Вазелин – результат соединения твердых и жирных алканов с количеством атомов углерода меньше 25. Вещество участвует в создании медицинских мазей.
Парафин, полученный в результате комбинирования твердых алканов, является твердой безвкусной массой, белого цвета и без аромата. Из вещества производят свечи, пропитывающую субстанцию для упаковочной бумаги и спичек. Также парафин популярен при осуществлении тепловых процедур в косметологии и медицине.
Обратите внимание! На основе алкановых смесей также делают синтетические волокна, пластмассы, моющую химию и каучук.
Галогенопроизводные алкановые соединения выполняют функции растворителей, хладагентов, а также основного вещества для дальнейшего синтеза.
Полезное видео: алканы — химические свойства
Вывод
Алканы являются ациклическими углеводородными соединениями, обладающими линейной или разветвленной структурой. Между атомами установлена одинарная связь, которая не поддается разрушению. Реакции алканов, основанные на замещении молекул, свойственные этому виду соединений. Гомологический ряд имеет общую структурную формулу CnH2n+2. Углеводороды относятся к насыщенному классу, поскольку содержат максимально допустимое количество атомов водорода.
Определение 1
Алканами называют такие углеводороды, атомы углерода, в молекулах которых соединены между собой простыми (одинарными) $\sigma $- связями. Все остальные единицы валентности атомов углерода в этих соединениях заняты (насыщенны) атомами водорода.
Атомы углерода в молекулах насыщенных углеводородов находятся в первом валентном состоянии, то есть в состоянии $sp3$-гибридизации. Такие насыщенные углеводороды еще называют парафинами .
Парафинами эти органические соединения называют потому, что долгое время их считали малореакцийноспособными (от лат. parum - мало и affinis - имеет сродство).
Старое название насыщенных углеводородов - алифатические или жирные, углеводороды (от лат. alifatic - жирный). Это название происходит от названия первых изученных соединений, которые когда-то относили к этим веществам, - жиров.
Насыщенные углеводороды образуют ряд соединений с общей формулой $C_nH_{(2_n+2)}$ $(n - 1, 2, 3, 4, ...)$. Простой соединением этого ряда является метан $CH_4$. Поэтому ряд этих соединений называют еще рядом метановых углеводородов.
Гомологические ряды
Соединения ряда метана имеют подобные строение и свойства. Такой ряд соединений, представители которого имеют близкие химические свойства и характеризуются закономерной сменой физических свойств, имеют однотипную структуру и отличаются друг от друга на одну или несколько $-CH_2$-групп, называют гомологичным рядом (от греч. «гомос » - сходство). Каждый последующий углеводород данного ряда отличается от предыдущего на группу $-CH_2$. Эта группа называется гомологичной разницей, а отдельные члены этого ряда - гомологами.
Происхождение названий алканов
Названия первых четырех насыщенных углеводородов (метан, этан, пропан, бутан) возникли случайно. Например, корень слова «этан» произошел от латинского слова ether - эфиы, так как остаток этана $-C_2H_5$ входит в состав медицинского эфира. Начиная с $C_5H_{12}$, названия алканов образованы от греческих или латинских числительных, которые указывают количество углеродных атомов в молекуле данного насыщенного углеводорода с добавлением к этим названиям суффикса -ан. Так, углеводород $C_5H_{12}$ называется пентан (от греч. «пента » - пять), $C_6H_{14}$ - гексан (от греч. «гекса » - шесть), $C_7H_{10}$ - гептан (от греч. «гепта » - семь) и т. д.
Правила систематической номенклатуры
Для названия органических веществ комиссией Международного союза теоретической и прикладной химии (IUPAC) были разработаны правила систематической (научной) номенклатуры. Согласно этим правилам, названия углеводородам дают таким образом:
В молекуле углеводорода выбирают основную - длинную и сложную (которая имеет наибольшее число ответвлений) - углеродную цепь.
Нумеруют атомы углерода основной цепи. Нумерацию осуществляют последовательно с того конца цепи, который дает радикалу наименьший номер. Если существует несколько алкильных радикалов, то сравнивают величину цифр двух возможных последовательных нумерации. И нумерация, в которой первой встречается меньше цифра, чем во второй последовательной нумерации, считается «меньше» и используется для составления названия углеводорода.
Нумерация справа налево будет «меньше», чем нумерация слева направо.
Называют углеводородные радикалы, которые образуют боковые цепи. Перед названием каждого радикала ставят цифру, которая указывает номер углеродного атома главной цепи, у которого с находится данный радикал. Цифру от названия отделяют дефисом. Названия алкильных радикалов перечисляют в алфавитном порядке. Если углеводород имеет в своем составе несколько одинаковых радикалов, то записывают в порядке возрастания номера углеродных атомов, у которых стоят эти радикалы. Цифры отделяют друг от друга запятыми. После цифр записывают префиксы: ди- (если одинаковых радикалов два), три- (когда одинаковых радикалов три), тетра-, пента- и т. д. (если одинаковых радикалов соответственно четыре, пять и т. д.). Префиксы указывают, сколько одинаковых радикалов имеет данный углеводород. После префикса ставят название радикала. В том случае, если два одинаковых радикалы находятся у одного углеродного атома, номер этого атома углерода ставится в названии дважды.
Называют углеводород основной пронумерованной углеродной цепи, помня при этом, что названия всех насыщенных углеводородов имеют суффикс -ан.
Приведенный ниже пример поможет уяснить эти правила:
Рисунок 1.
Алкильные радикалы боковых цепей
Иногда алкильные радикалы боковых цепей разветвленные. В этом случае их называют так, как соответствующие насыщенные углеводороды, только вместо суффикса -ан принимают суффикс -ил.
Углеродную цепь разветвленного радикала нумеруют. Атом углерода этого радикала, соединенный с основным цепью, получает номер $1$. Для удобства углеродную цепь разветвленного радикала нумеруют цифрами со штрихами и полное название такого радикала берут в скобки:

Рисунок 2.
Рациональная номенклатура
Кроме систематической для названия насыщенных углеводородов используют еще рациональную номенклатуру. По этой номенклатуре насыщенные углеводороды рассматривают как производные метана, в молекуле которого один или несколько атомов водорода замещены на радикалы. Название насыщенного углеводорода по рациональной номенклатуре образуют таким образом: называют по степени сложности все радикалы, которые находятся у атома углерода с наибольшим количеством заместителей (отмечая их количество, если они одинаковые), а затем добавляют основу названия углеводорода по этой номенклатуре - слово «метан». К примеру:
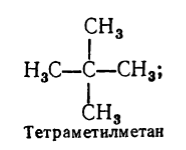
Рисунок 3.
Рациональную номенклатуру пользуются для названия сравнительно простых углеводородов. Эта номенклатура не так усовершенствована и гораздо менее удобна в пользовании по сравнению с систематической номенклатурой. По рациональной номенклатуре одно и то же вещество может иметь разные названия, что очень неудобно. Кроме того, по данной номенклатуре можно назвать далеко не все насыщенные углеводороды.
Углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле C n H 2 n
+2
.
В молекулах алканов все атомы углерода находятся в состоянии sр 3 -гибридизации. Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды - тетраэдра. Углы между орбиталями равны 109° 28′.
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму с углами при атомах углерода, близкими к тетраэдрическому (109° 28′), например, в молекуле н -пентана.

Особо стоит напомнить о связях в молекулах алканов. Все связи в молекулах предельных углеводородов одинарные. Перекрывание происходит по оси,
соединяющей ядра атомов, т. е. это σ-связи. Связи углерод - углерод являются неполярными и плохо поляризуемыми. Длина С-С связи в алканах равна 0,154 нм (1,54 10 — 10 м). Связи С-Н несколько короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С-Н является слабополярной.
Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде, не вступают во взаимодействие с заряженными частицами (ионами). Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов.
Гомологический ряд метана
Гомологи - вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН 2 .

Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкан, для которого характерны структурные изомеры, - это бутан.
Основы номенклатуры
1. Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи - самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи.
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (-СН 3), затем этил (-СН 2 -СН 3), пропил (-СН 2 -СН 2 -СН 3) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс —ил
в названии соответствующего алкана.
3. Формирование названия
. В начале названия указывают цифры - номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди
- два, три
- три, тетра
- четыре, пента
- пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов - название главной цепи. Главная цепь называется как углеводород - член гомологического ряда метана (метан
СН 4 , этан
С 2 Н 6 , пропан
C 3 H 8 , С 4 Н 10, пентан
С 5 Н 12 , гексан
С 6 Н 14 , гептан
C 7 H 16, октан
C 8 H 18, нонан
С 9 Н 20, декан
С 10 Н 22).

Физические свойства алканов
Первые четыре представителя гомологического ряда метана - газы. Простейший из них - метан - газ без цвета, вкуса и запаха (запах «газа», почувствовав который, надо звонить 04, определяется запахом меркаптанов - серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от С 4 Н 12 до С 15 Н 32 - жидкости; более тяжелые углеводороды - твердые вещества. Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства алканов
Реакции замещения.
Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу. Приведем уравнения характерных реакций галогенирования:
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
Реакция дегидрирования
(отщепления водорода)
.
В ходе пропускания алканов над катализатором (Pt, Ni, А1 2 0 3 , Сг 2 0 3) при высокой температуре (400-600 °С) происходит отщепление молекулы водорода и образование алкена:
Реакции, сопровождающиеся разрушением углеродной цепи.
Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться.
1. Горение предельных углеводородов
- это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
В общем виде реакцию горения алканов можно записать следующим образом:
2. Термическое расщепление углеводородов.
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
Реакции термического расщепления лежат в основе промышленного процесса - крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
3. Пиролиз
. При нагревании метана до температуры 1000 °С начинается пиролиз метана - разложение на простые вещества:![]()
При нагревании до температуры 1500 °С возможно образование ацетилена:
4. Изомеризация
. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
5. Ароматизация
. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
Алканы вступают в реакции, протекающие по свободнорадикальному механизму, т. к. все атомы углерода в молекулах алканов находятся в состоянии sp 3 -гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С-С (углерод - углерод) связей и слабополярных С-Н (углерод - водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т. к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Простейшими органическими соединениями являются углеводороды , состоящие из углерода и водорода. В зависимости от характера химических связей в углеводородах и соотношения между углеродом и водородом они подразделяются на предельные и непредельные (алкены, алкины и др.)
Предельными углеводородами (алканами, углеводородами метанового ряда) называются соединения углерода с водородом, в молекулах которых каждый атом углерода затрачивает на соединение с любым другим соседним атомом не более одной валентности, причем, все не затраченные на соединение с углеродом валентности насыщены водородом. Все атомы углерода в алканах находятся в sp 3 - состоянии. Предельные углеводороды образуют гомологический ряд, характеризующийся общей формулой С n Н 2n+2 . Родоначальником этого ряда является метан.
Изомерия. Номенклатура.
Алканы с n=1,2,3 могут существовать только в виде одного изомера
Начиная с n=4, появляется явление структурной изомерии.

Число структурных изомеров алканов быстро растет с увеличением числа углеродных атомов, например, пентан имеет 3 изомера, гептан - 9 и т.д.
Число изомеров алканов увеличивается и за счет возможных стереоизомеров. Начиная с C 7 Н 16 возможно существование хиральных молекул, которые образуют два энантиомера.
Номенклатура алканов.
Доминирующей номенклатурой является номенклатура IUPAC. В тоже время в ней присутствуют элементы тривиальных названий. Так, первые четыре члена гомологического ряда алканов имеют тривиальные названия.
СН 4 - метан
С 2 Н 6 - этан
С 3 Н 8 - пропан
С 4 Н 10 - бутан.
Названия остальных гомологов образованы от греческих латинских числительных. Так, для следующих членов ряда нормального (неразветвленного) строения используются названия:
С 5 Н 12 - пентан, С 6 Н 14 - гексан, С 7 Н 18 - гептан,
С 14 Н 30 - тетрадекан, С 15 Н 32 - пентадекан и т.д.
Основные правила IUPAC для разветвленных алканов
а) выбирают наиболее длинную неразветвленную цепь, название которой составляет основу (корень). К этой основе прибавляют суффикс “ан”
б) нумеруют эту цепь по принципу наименьших локантов,
в) заместитель указывают в виде префиксов в алфавитном порядке с указанием места нахождения. Если при родоначальной структуре находятся несколько одинаковых заместителей, то их количество указывают греческими числительными.
В зависимости от числа других углеродных атомов, с которыми непосредственно связан рассматриваемый углеродный атом, различают: первичные, вторичные, третичные и четвертичные углеродные атомы.


В качестве заместителей в разветвленных алканах фигурируют алкильные группы или алкильные радикалы, которые рассматриваются как результат отщепления от молекулы алкана одного водородного атома.
Название алкильных групп образуют от названия соответствующих алканов путем замены последних суффикса “ан” на суффикс “ил”.
СН 3 - метил
СН 3 СН 2 - этил
СН 3 СН 2 СН 2 - пропил

Для названия разветвленных алкильных групп используют также нумерацию цепи:

Начиная с этана, алканы способны образовывать конформеры, которым соответствует заторможенная конформация. Возможность перехода одной заторможенной конформации в другую через заслоненную определяется барьером вращения. Определение структуры, состава конформеров и барьеров вращения являются задачами конформационного анализа. Методы получения алканов.
1. Фракционная перегонка природного газа или бензиновой фракции нефти. Таким способом можно выделять индивидуальные алканы до 11 углеродных атомов.
2. Гидрирование угля. Процесс проводят в присутствии катализаторов (оксиды и сульфиды молибдена, вольфрама, никеля) при 450-470 о С и давлениях до 30 Мпа. Уголь и катализатор растирают в порошок и в суспензированном виде гидрируют, борботируя водород через суспензию. Получающиеся смеси алканов и циклоалканов используют в качестве моторного топлива.
3. Гидрирование СО и СО 2 .
СО + Н 2 алканы
СО 2 + Н 2 алканы
В качестве катализаторов этих реакций используют Со, Fe, и др. d - элементы.
4. Гидрирование алкенов и алкинов.

5. Металлоорганический синтез.
а). Синтез Вюрца.
2RHal + 2Na R R + 2NaHal
Этот синтез малопригоден, если в качестве органических реагентов используют два разных галогеналкана.
б). Протолиз реактивов Гриньяра.
R Hal + Mg RMgHal
RMgHal + HOH RH + Mg(OH)Hal
в). Взаимодействие диалкилкупратов лития (LiR 2 Cu) с алкилгалогенидами
LiR 2 Cu + R X R R + RCu + LiX
Сами диалкилкупраты лития получают двухстадийным способом
2R Li + CuI LiR 2 Cu + LiI
6. Электролиз солей карбоновых кислот (синтез Кольбе).
2RCOONa + 2H 2 O R R + 2CO 2 + 2NaOH + H 2

7. Сплавление солей карбоновых кислот со щелочами.
Реакция используется для синтеза низших алканов.
8. Гидрогенолиз карбонильных соединений и галогеналканов.
а). Карбонильные соединения. Синтез Клемменса.

б). Галогеналканы. Каталитический гидрогенолиз.
![]()
В качестве катализаторов используют Ni, Pt, Pd.
в) Галогеналканы. Реагентное восстановление.
RHal + 2HI RH + HHal + I 2
Химические свойства алканов.
Все связи в алканах малополярные, по этому для них характерны радикальные реакции. Отсутствие пи-связей делает невозможными реакции присоединения. Для алканов характерны реакции замещения, отщепления, горения.
|
Тип и название реакции | |
|
1. Реакции замещения | |
|
А) с галогенами (с хлором Cl 2 –на свету , Br 2 - при нагревании ) реакция подчиняется правилу Марковника (Правила Марковникова ) - в первую очередь галоген замещает водород у наименее гидрированного атома углерода. Реакция проходит поэтапно - за один этап замещается не более одного атома водорода. Труднее всего реагирует иод, и притом реакция не идет до конца, так как, например, при взаимодействии метана с йодом образуется йодистый водород, реагирующий с йодистым метилом с образованием метана и йода(обратимая реакция): |
CH 4 + Cl 2 → CH 3 Cl + HCl (хлорметан) CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорметан) CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (трихлорметан) CHCl 3 + Cl 2 → CCl 4 + HCl (тетрахлорметан). |
|
Б) Нитрование (Реакция Коновалова) Алканы реагируют с 10% раствором азотной кислоты или оксидом азота N 2 O 4 в газовой фазе при температуре 140° и небольшом давлении с образованием нитропроизводных. Реакция так же подчиняется правилу Марковникова. Один из атомов водорода заменяется на остаток NO 2 (нитрогруппа) и выделяется вода |
|
|
2. Реакции отщепления | |
|
А) дегидрирование –отщепление водорода. Условия реакции катализатор –платина и температура. |
CH 3 - CH 3 → CH 2 = CH 2 + Н 2 |
|
Б) крекинг процесс термического разложения углеводородов, в основе которого лежат реакции расщепления углеродной цепи крупных молекул с образованием соединений с более короткой цепью. При температуре 450–700 o С алканы распадаются за счет разрыва связей С–С (более прочные связи С–Нпри такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов |
C 6 H 14 C 2 H 6 + C 4 H 8 |
|
В) полное термическое разложение |
СН 4 C + 2H 2 |
|
3. Реакции окисления | |
|
А) реакция горения При поджигании (t = 600 o С) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды. |
С n Н 2n+2 + O 2 ––>CO 2 + H 2 O + Q СН 4 + 2O 2 ––>CO 2 + 2H 2 O + Q |
|
Б) Каталитическое окисление - при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–Спримерно в середине молекулы и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов. |
Например, при неполном окислении бутана (разрыв связи С 2 –С 3) получают уксусную кислоту |
|
4. Реакции изомеризациих арактерны не для всех алканов. Обращается внимание на возможность превращения одних изомеров в другие, наличие катализаторов. |
С 4 Н 10 C 4 H 10 |
|
5.. Алканы с основной цепью в 6 и более атомов углерода также вступают в реакцию дегидроциклизации, но всегда образуют 6-членный цикл (циклогексан и его производные). В условиях реакции этот цикл подвергается дальнейшему дегидрированию и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода (арена). |
|
Механиз реакции галогенирования:
Галогенирование
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Галогенирование - это одна из реакций замещения. Галогенирование алканов подчиняется правилу Марковника (Правила Марковникова) - в первую очередь галогенируется наименее гидрированый атом углерода. Галогенирование алканов проходит поэтапно - за один этап галогенируется не более одного атома водорода.
CH 4 + Cl 2 → CH 3 Cl + HCl (хлорметан)
CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорметан)
CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (трихлорметан)
CHCl 3 + Cl 2 → CCl 4 + HCl (тетрахлорметан).
Под действием света молекула хлора распадается на атомы, затем они атакуют молекулы метана, отрывая у них атом водорода, в результате этого образуются метильные радикалы СН 3 , которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Нитрование (Реакция Коновалова)
Алканы реагируют с 10% раствором азотной кислоты или оксидом азота N 2 O 4 в газовой фазе при температуре 140° и небольшом давлении с образованием нитропроизводных. Реакция так же подчиняется правилу Марковникова.
RH + HNO 3 = RNO 2 + H 2 O
т. е. один из атомов водорода заменяется на остаток NO 2 (ни-трогруппа) и выделяется вода.
Особенности строения изомеров сильно отражаются на течении этой реакции, так как легче всего она ведет к замещению на нитрогруппу атома водорода в остатке СИ (имеющемся лишь в некоторых изомерах), менее легко замещается водород в группе СН 2 и еще труднее - в остатке СН 3 .
Парафины довольно легко нитруются в газовой фазе при 150-475° С двуокисью азота или парами азотной кислоты; при этом происходит частично и. окисление. Нитрованием метана получается почти исключительно нитрометан:
Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов. Азотная кислота при обыкновенной температуре почти не действует на парафиновые углеводороды. При нагревании же действует главным образом как окислитель. Однако, как нашел М. И. Коновалов (1889), при нагревании азотная кислота действует отчасти и «нитрующим» образом; особенно хорошо идет реакция нитрования со слабой азотной кислотой при нагревании и повышенном давлении. Реакция нитрования выражается уравнением.
Последующие за метаном гомологи дают смесь различных нитропарафинов вследствие попутно идущего расщепления. При нитровании этана получаются нитроэтан СН 3 -СН 2 -NO 2 и нитрометан СН 3 -NO 2 . Из пропана образуется смесь нитропарафинов:
Нитрование парафинов в газовой фазе теперь осуществляется в промышленном масштабе.
Сульфахлорирование:
Важной в практическом отношении реакцией является сульфохлорирование алканов. При взаимодействии алкана с хлором и сернистым ангидридом при облучении происходит замещение водорода на хлорсульфонильную группу:

Стадии этой реакции:
Cl +R:H→R +HCl
R +SO 2 →RSO 2
RSO 2 + Cl:Cl→RSO 2 Cl+Cl
Алкансульфохлориды легко гидролизуются до алкансульфоксилост (RSO 2 OH),натриевые соли которых (RSO 3¯ Na + - алкансульфонат натрия) проявляют свойства,подобные мылам, и применяются в качестве детерагентов.











